薬剤師のしぐです。
医療費削減のために、国が使用促進しているGE医薬品。
黒柳徹子さんや高橋英樹さんのおかげ(?)で数年前に比べて認知度はすごく高くなりました。
調剤薬局では2020年までに、GE使用率国内平均80%を目標に数年前から調剤報酬にも盛り込まれていますね。
同様に医療費削減のために登場したのがこのバイオシミラー。

GE医薬品と同じでしょ?とか、物が物だけにGEとは違うと思うけど、、、明確に何が違うかっていうのはわからない、、など薬剤師さんでも曖昧なところがあると思うので、まとめてみました。
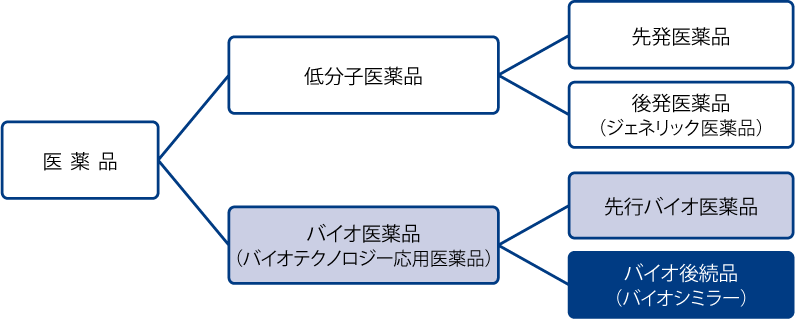
バイオ医薬品とは
まずバイオ医薬品 ( 生物学的製剤 ) とは、生体が作る物質を使用した薬剤です。遺伝子組換え、ウイルスやバクテリアの培養など、最先端のバイオテクノロジーを応用して製造され、高分子で構造が複雑な医薬品です。
有効成分はタンパク質となり、構造が複雑な分、低分子医薬品に比べて製造工程も複雑になります。
簡単にいうと生物のタンパク質を作る力を利用して作る医薬品ってこと!
生物はアミノ酸をつなげることでタンパク質を作る力を持ってるんですよね。
ホルモン、酵素、抗体等のタンパク質を有効成分とする医薬品がほとんどで、代表的なバイオ医薬品としてはインスリンや成長ホルモン、エリスロポエチン、インターロイキン、インターフェロンなどがあります。
このバイオ医薬品の開発により,これまで低分子医薬品では十分に治療できなかったさまざまな病気の治療が飛躍的に変りました。特にこれまで治療が困難であったがんや関節リウマチなどの免疫関連の病気の治療に貢献しています。
ただ、バイオ医薬品は開発や製造にコストがかかるため高価となり,医療費が高額になっています。ここで、医療費削減のために開発が進められているのがバイオシミラーということですね。
ちなみに、日本で最初に発売されたバイオ医薬品は「インスリン」なんだよ。1985年にヒトインスリンのアミノ酸配列に対応した遺伝子を化学合成で大腸菌に組み込み、それを培養することでヒトインスリンを安定して、大量に製造することが可能になったんだって。
バイオシミラー(バイオ後続品)とは
バイオシミラー(バイオ後続品)とは、「既に国内で新薬として承認され、特許が満了したバイオテクノロジー医薬品 (先行バイオ医薬品)の後続品として、先行バイオ医薬品とは異なる製造販売会社が開発した医薬品」として定義されています。
化学合成ではなく細胞や細菌が作り出すバイオ医薬品は、分子量が大きく構造が複雑なため製造方法が変わると品質に微妙な変化が生じるため、低分子医薬品の有効成分のようにはまったく同じものを作ることができません。
このため、バイオシミラーは先行バイオ医薬品とまったく同じではないものの、高度に類似するものとなります。「先行品に似たバイオ医薬品」という意味で、バイオシミラー ( similar;類似した、同様の ) と呼ばれています。
位置付け的には、先発品の特許が切れた後に発売されることから後発医薬品(GE医薬品)と同じように考えられていますが、実際は違う部分も多々あります。
バイオシミラーは、先行バイオ医薬品より薬の価格が安く、薬剤費の負担が軽減されることがメリットです。薬価が先行バイオ医薬品の約70%に抑えられるため,患者さんの負担や国の医療費の伸びを抑えられる可能性があります。
日本では、2009年にソマトロピンが初のバイオシミラーとして販売開始されました。
バイオシミラーの名称
販売名には決まりがあります。
「先行バイオ医薬品の一般名」+「BS」+「剤形・含量」+「会社名」
BSはバイオシミラーの略ですね〜
バイオシミラーと後発医薬品(GE医薬品)の違い
まず、GE医薬品は先発医薬品と同一の有効成分を同一量含有していることから、薬物動態が生物学的に同等であれば有効性および安全性も同等であるとみなされます。そのため、ジェネリック医薬品では有効性と安全性を確認するために臨床試験を行う必要はありません。
バイオ医薬品は薬品の構造が複雑であるため、バイオシミラーが先発のバイオ医薬品と全く同じ主成分と効果を持つ薬であるという「同一性」(GE医薬品の製造の際に求められる条件)を示すことは非常に困難です。
バイオシミラーには同一性が求められない代わりに、「同等性・同質性」が求められます。先行バイオ医薬品と品質,安全性,有効性において同等性・同質性を示すことが必要なため、バイオシミラーの開発においては新薬と同様臨床試験等の多くの試験が行われます。
承認申請時に必要な資料は、ジェネリック医薬品では最大4種類ですが、バイオシミラーでは臨床試験成績を含む最大20種類に上ります。まさかの5倍の量ですね。また、発売後も副作用の発現状況や効果を確認する調査が行われます。
バイオシミラーは、2009年3月に厚生労働省医薬食品局長より通知された「バイオ後続品の承認申請について」において、薬事申請上、新薬ともジェネリック医薬品とも異なる新しい区分として分類されています。
実際の取り扱いについて
ではでは、このバイオシミラーを実際に薬局で取り扱うにあたっての注意点として、
先発品からバイオシミラーへの変更調剤は、「禁止されてはいないけど、厚生労働省のバイオシミラー使用ガイドラインによると推奨していない」みたいです。
理由としては、「安全性についての製造販売後調査が必要であり、その間は代替または混用を避ける必要がある」からだとか。
えーーと、ようするに、変更調剤はしないほうがいいってことね。
ダメじゃないよ?ダメじゃないけどさー。これって、ほぼダメってことですよね?
日本人っぽい言い回し。ですよね。
バイオシミラーについてのまとめ
大事なのはこの2つ!
- GEとは違う分類で、承認条件も厳しいよ
- 薬局で勝手に変更調剤はしないほうがいいよ。
むしろ、いっそのことできないって覚えておいてもいいくらいだよ。

ちなみに、世界の医薬品売上ランキングだと上位の半分以上はバイオ医薬品なんだとか。
これからは世界的にもバイオシミラーがどんどん普及していくんでしょうね。
日本でよく見るバイオシミラーはなんと言っても「インスリングラルギン」ですよね!
なんなら病院での採用を完全にバイオシミラーに切り替えてるところも多いとか。
このインスリングラルギン、唯一先発の「ランタス注ソロスター」と「インスリングラルギン注ミリオぺンBSリリー」で違いがある部分。知ってますか??
まあ、成分とは全く関係ない「ソロスター」と「ミリオペン」での違いになってくるのですが、【注入後の保持時間】に違いがあります。
「ソロスター」は注入後10秒以上。「ミリオペン」は注入後5秒以上の保持を推奨してます。
一応ね。こういった違いがあるってことのご紹介でした。
「インスリン初のバイオシミラー」だったり「薬局で取り扱うことができる初のバイオシミラー」だったりで、薬局薬剤師が初めてバイオシミラーという言葉を知るきっかけになった製品ですね。
他にも「レミケード」のBS「インフリキシマブ」や、「リツキサン」のBS「リツキシマブ」などがありますね。点滴として院内で使用するものがほとんどです。
BSは、DPC/PDPS対象病院に限定すると85%を超える採用率なんだって!
あと、比較的最近「エンブレル」のBS「エタネルセプト」が発売になって話題になってます。
エンブレル皮下注は取り扱ってる病院、薬局さんもけっこう多いと思うので、今後どんどん見る機会も増えていくような気がします。
こんな感じですねーーーバイオシミラー。
BSの普及は、医療費の削減や患者の自己負担の軽減につながるだけでなく、製薬会社業界の国際的な競争力の強化に関係してるようで、国も普及に力を入れてるんだとか。
バイオシミラー協議会やらなんやらがあるみたいですからね。
さらにバイオ医薬品のAG的なもので、「バイオセイム」ってのも出てきてます。このバイオセイムは類似品(シミラー)ではなくなるので、薬価も後発品同等の「0.5かけ」になる可能性があるみたい。
ではではっしぐでした。



コメント
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] バイオシミラーとは?インスリンや抗リウマチ薬、抗がん剤で登場。薬価差やジェネリックとの違い薬剤師のしぐです。医療費削減のために、国が使用促進しているGE医薬品。黒柳徹子 […]