薬剤師のしぐです。
これまでも、いくつかの自主回収の内容を書いてきましたが、今回はその中でも1番処方頻度が高いんじゃないかと思われる医薬品「メトグルコ錠」についてです。
以前、2019.12に「メトホルミン塩酸塩における発がん性物質に関する分析」についてまとめたことがあったのですが、その延長になるようですね。
では、カンタンにまとめてみます。
メトグルコ錠の自主回収理由
大日本住友製薬さんからは2020.4/27に下記メトグルコ錠の自主回収についての通知が出てます。

というわけで、要点はここですね。
厚生労働省の 2019 年 12 月 9 日付け事務連絡「メトホルミン塩酸塩における発がん性物質に関する 分析について(依頼)」において、メトホルミン塩酸塩を含有する有効期限内の製剤および当該製剤に使 用されている原薬について発がん性物質 N-ニトロソジメチルアミン(以下「NDMA」)の分析が指示されま した。これを受けて、当社は、本剤の製剤および原薬を分析した結果、PTP 包装品の複数のロットから管理指標を超える NDMAが検出されたため、管理指標を超えたロットおよび超えている可能性のあるロットのPTP包装品について、医療機関および特約店から自主回収をすることとしました。
原因は明確ではありませんが、本剤の PTP アルミ箔の錠剤接触面の印刷インクに含まれるニトロセ ルロース系樹脂由来の物質が、錠剤中の原薬に僅かに残留していた原料であるジメチルアミンと反応してNDMAが生成された可能性があると考えています。
NDMA は発がん性物質であり、重篤な健康被害に至る可能性は否定できませんが、これまでに本剤を服用された患者さんで NDMA に関連した重篤な健康被害等の報告は受けていません。
ということですね。
NDMAとは
一応、コチラにまとめておきます。
NDMAとは「N-ニトロソジメチルアミン」の略です。
発がん性が確認されている、環境汚染物質の1つ。様々な産業の製造工程で発生したり、自然条件のもとでも発生する可能性があり、飲料水や肉、野菜、乳製品からも検出されます。
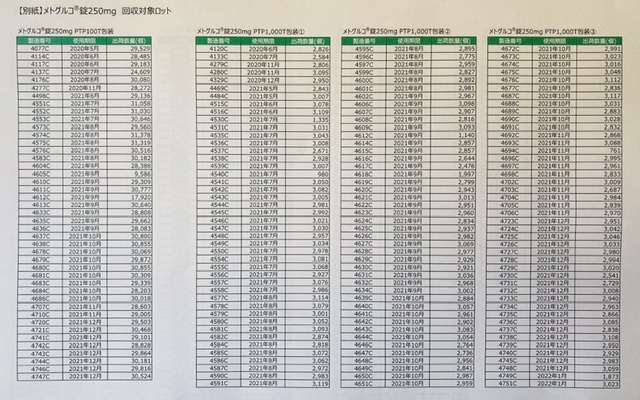
メトグルコ錠自主回収対象ロット
対象ロットが、とてもたくさんありますがコチラ。まずはメトグルコ錠250mg。
こっちがメトグルコ錠500mgです。
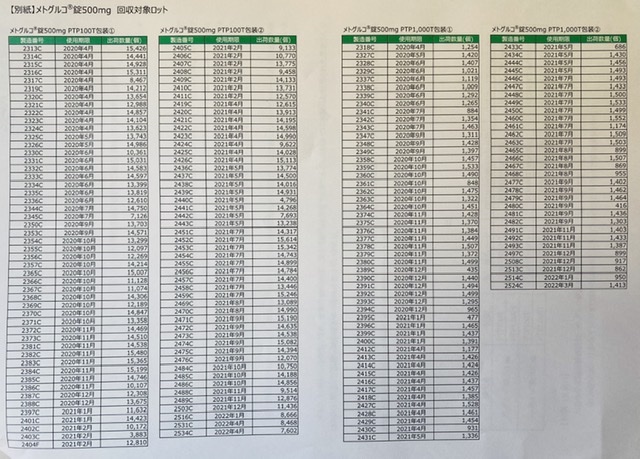
半年前〜1年前あたりに出荷されてる分のようです。
詳細はコチラ→ https://ds-pharma.jp
回収対象ロットの流通状況
Yahooさんのニュースでも、こういった方に出てますね。
大日本住友製薬は27日、糖尿病治療薬「メトグルコ錠」約302万箱を自主回収すると発表した。厚生労働省の要請を受けた検査の結果、一部で基準を超える発がん性物質が検出されたため。
この薬は患者の血糖値を下げるため使われていた。回収するのは「メトグルコ錠250mg」と「メトグルコ錠500mg」の2種類。2017年9月から19年12月にかけて全国の薬局や医療機関、延べ約7万施設に納入された。既にほとんどが服用されたとみられるが、これまでに健康被害の報告はないという。
自分の薬局では250mgが毎日1000〜3000錠くらい、500mgを毎日1000錠くらい調剤で使用します。
なので、半年前の在庫が残ってるわけもなく。Yahooさんのニュース同様、回収品の在庫はなかったです。
調剤済みメトグルコ錠に対する患者対応
メトグルコ錠ともなると、患者さんからの問い合わせも多く、

「自分が今服用しているメトグルコ錠は大丈夫だろうか?」
という電話もすでに数件受けてます。
電話がなると、コロナ関連の問合せか、メトグルコ錠か、、、といった感じ。
一応、こういった患者さんへの対応としては
メトグルコ錠に関するNDMAの長期管理設定では、1日2250mg【最大用量】を70年間服用継続し続けたとしても「10万人に1人にだけ」発癌のリスクが増えるか、それ以下かです。これは特にメトグルコ錠を服用していない健常者と変わらない確率なので、安心して継続してください。
発癌リスクよりも、血糖値上昇により様々な合併症発生リスクの方が高まるのでしっかり継続していただいた方が良いかと考えられます。
といった感じで。大日本住友製薬さんからも回答いただいてます。
今回はこんな感じですね。
みなさんのところには、多かれ少なかれ患者さんからの問い合わせは来てますか??
意外と、以前書いたメトホルミン関連の中に色々な情報書いていたので新しく書くことはなかったです。
みなさんも、患者さんからの問い合わせが来た際に対応できるように、確認してみてください。
大日本住友製薬株式会社さんの「メトグルコ錠回収専用ダイアル」がコチラ。
0120-870-851
ロットや患者さん対応等、確認してみてください。
ではではーしぐでした。






コメント
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]
[…] […]